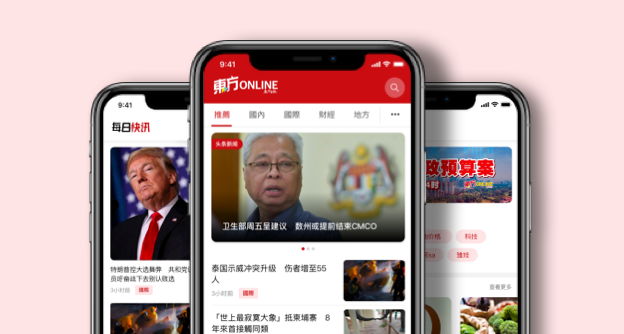
(布城30日讯)卫生总监丹斯里诺希山透露,目前全球共有12家公司正在进行疫苗第三阶段的临床测试,其中一家公司或会在下周,提交第三阶段的临床报告。
不过,诺希山强调,疫苗必须向食品药品监督管理局(FDA)注册,以及大马药剂监管局(NPRA)批准。
“我们正在等待研究结果,只有高效的疫苗,其副作用少,才会注册相关疫苗。”
他强调,卫生部也制定5个步骤处理疫苗的事项,那就是注册、供应、鉴定疫苗接收者、监督疫苗副作用,和评估疫苗有效性。
他说,不止是疫苗,所有药物都必须进行注册。
诺希山是在卫生部例常记者会上指出,我国目前正在针对疫苗进行谈判。
“所有病苗采用条件是疫苗必须先注册,若疫苗没有注册,之前的谈判与条约将视为无效。”
他透露,获取疫苗后,将优先让医疗前线人员接受疫苗,当局也会拟定疫苗的接收群体。
此外,诺希山说,卫生部也会密切监督疫苗所带来的副作用。
“若使用疫苗后出现副作用,就必须呈报卫生部,而卫生部将对此进行监督疫苗的有效性。”
他也说,由于卫生部曾经在购买呼吸辅助器和个人防护装备(PPE)时,都面临货源不足的情况。
“因此在吸取教训后,卫生部采取积极主动的方案,针对疫苗供应率先展开谈判。”