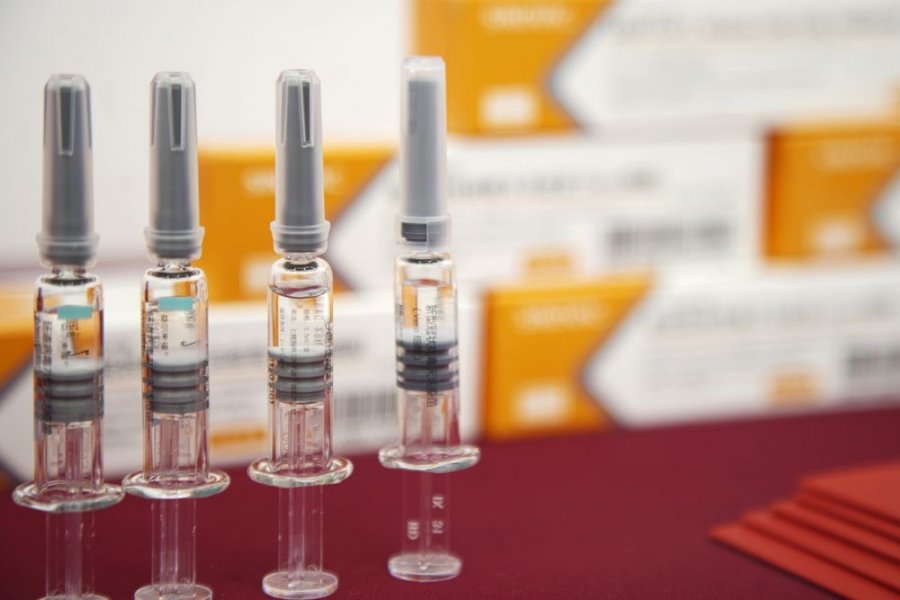
巴西圣保罗州政府19日指出,在巴西参加中国北京科兴生物公司(Sinovac Biotech,简称北京科兴)与圣保罗布坦坦(Instituto Butantan)研究所合作研发的实验疫苗CoronaVac第3阶段人体试验的9000名志愿者中,有35%出现轻微副作用,这些轻微的副作用包括头痛、接种部位肿胀。
据报导,圣保罗州长多利亚(João Doria)表示,临床研究的初步结果证明,在巴西测试的所有疫苗中,CoronaVac的不良反应率最低,是目前进展最快、最安全和最有希望的抵抗新冠肺炎疫苗。圣保罗州政府预定今年底提出疫苗有效性的数据。
圣保罗布坦坦研究所所长柯瓦斯(Dimas Covas)指出,到目前为止,巴西已在9000名志愿受试者中接种1.2万剂疫苗,其中35%出现头痛和接种部位肿胀,没有严重副作用的记录。
北京科兴生物公司9月底公布的研究指出,在中国参加试验的逾5万名志愿者中,只有5.36%的受试者出现程度轻微的不良反应,包括注射部位轻度疼痛(3.08%),疲劳(1.53%)和中度发烧(0.21%)。
柯瓦斯指出,CoronaVac的试验将扩大到1万3000名志愿者,包括老年人和儿童等高危险群,尤其是对老年人免疫反应的研究,以了解正常剂量疫苗在老年人中是否有效。
多利亚表示,只要国家卫生监测局(Anvisa)批准CoronaVac,预计12月下旬即可开始对医护人员进行预防接种。
根据圣保罗州政府与北京科兴生物公司签署的协定,北京科兴公司将在12月31日以前向圣保罗州提供4600万初始剂量,之后再由布坦坦研究所在2月底以前生产6000万剂。这些剂量将足以为圣保罗州4400万民众接种疫苗。
世界卫生组织(WHO)建议,应从医护人员和老年人等染疫高风险群开始,然后逐步让更多人接种。虽然如此,柯瓦斯表示,没有必要为所有人接种疫苗,因为随著群体免疫力提高,疫情将自然受到控制。
柯瓦斯指出,一旦中国疫苗在初步分析中证明至少50%的疗效,圣保罗州政府将向国家卫生监测局申请开放紧急使用CoronaVac。
另外,除了Coronavac外,英国牛津大学(Oxford)和药厂阿斯特捷利康(Astra Zeneca)合作研发的实验疫苗ChAdOx1 nCoV-19、德国BioNTech与美国辉瑞(Pfizer)药厂合作的mRNA基因疫苗BNT162,以及美国强生公司(Johnson & Johnson)旗下杨森药厂(Janssen Pharmaceuticals)研发的疫苗Ad26.COV2.S,目前也在巴西进行第3阶段人体试验。
其中强生公司的疫苗,因1名志愿受试者出现不明原因疾病,12日宣布对全球6万名接种疫苗的志愿者暂停进行第3阶段临床试验,其中7000名志愿者在巴西。
强生公司在声明中强调,不良反应是所有临床研究、尤其大型临床研究里常见的状况,但公司基于对安全的承诺,在出现与疫苗或药品有关的非预期严重不良事件(SAE)时,研究就会暂停。
强生还表示,由于试验有安慰剂组别,所以无法立刻判断参与者是接受的安慰剂还是试验疫苗。